歡迎您來到深圳欣博盛生物科技有限公司網(wǎng)站!
歡迎您來到深圳欣博盛生物科技有限公司網(wǎng)站!
要問2025年生物醫(yī)藥界誰最炙手可熱,體內(nèi)CAR-T必定是大熱門。一邊是資本市場(chǎng)眼花繚亂的并購(gòu)與融資,MNC紛紛出手欲求搶占先機(jī),僅并購(gòu)金額已近50億美元。一邊是頂刊頻發(fā),從動(dòng)物模型到臨床病人數(shù)據(jù)亮眼,國(guó)內(nèi)國(guó)外兩開花,有競(jìng)爭(zhēng)有合作。9月30日,CAR-T先驅(qū)同時(shí)也是Capstan聯(lián)合創(chuàng)始人的Carl June教授攜手10家行業(yè)公司科學(xué)家共同在Nature Review Drug Discovery發(fā)表綜述文章,一時(shí)間體內(nèi)CAR-T賽道有數(shù)據(jù)、有資金、有夢(mèng)想、有協(xié)作,前景似乎一片光明。
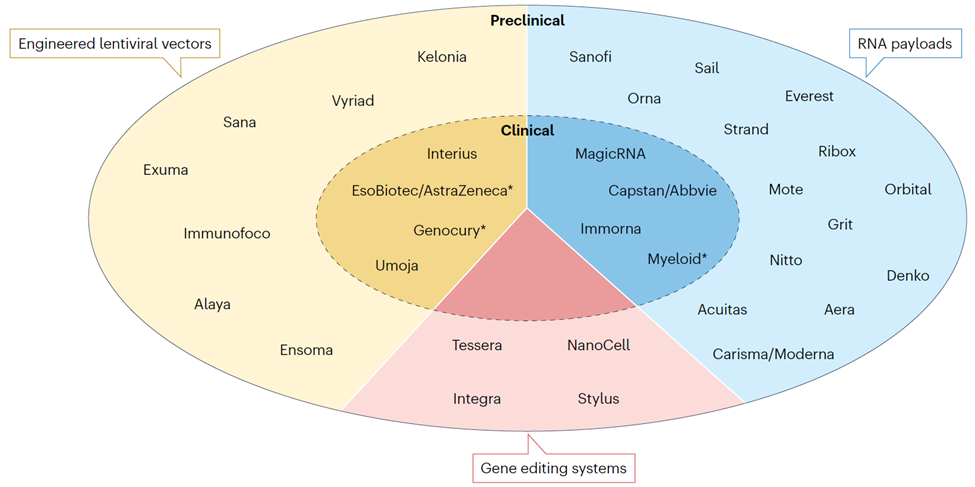
快速發(fā)展的體內(nèi)CAR-T生態(tài)
體內(nèi)CAR-T:"沒有細(xì)胞的細(xì)胞療法"
自體CAR-T細(xì)胞療法在血液腫瘤治療中取得了革命性成功,但其制備工藝復(fù)雜,時(shí)間周期長(zhǎng),治療成本高,還有細(xì)胞因子釋放綜合征(CRS)等副作用風(fēng)險(xiǎn),高度個(gè)性化,嚴(yán)重制約了可及性和實(shí)際應(yīng)用。體內(nèi)CAR-T細(xì)胞療法則有望成為一種替代方案克服上述挑戰(zhàn),其利用可以規(guī)模化生產(chǎn)的靶向遞送系統(tǒng)將編碼CAR的遺傳物質(zhì)導(dǎo)入內(nèi)源T細(xì)胞,直接在患者體內(nèi)生成CAR-T細(xì)胞,省去了體外細(xì)胞處理、運(yùn)輸和基于化療的清淋預(yù)處理。

體內(nèi)自體CAR-T、體外同種異體CAR-T(通用CAR-T)與體內(nèi)CAR-T細(xì)胞療法比較
實(shí)現(xiàn)體內(nèi)CAR-T技術(shù)的關(guān)鍵在于將CAR基因精準(zhǔn)遞送到體內(nèi)的T細(xì)胞,并在T細(xì)胞中精準(zhǔn)表達(dá),同時(shí)最大限度減少致病性細(xì)胞或其他細(xì)胞(如造血干細(xì)胞)的攝取。目前進(jìn)入臨床開發(fā)階段的體內(nèi)CAR-T主要有兩大類技術(shù)平臺(tái):
☆ 攜帶整合型載荷的工程化病毒載體,最主要是慢病毒,通過工程化改造病毒包膜蛋白展示識(shí)別T細(xì)胞特異性表面標(biāo)志物的高親和力結(jié)合劑,同時(shí)消除載體與細(xì)胞表面天然受體的互作,實(shí)現(xiàn)對(duì)患者T細(xì)胞的高度選擇性基因轉(zhuǎn)移。這類平臺(tái)可使T細(xì)胞根據(jù)抗原的存在和負(fù)荷,自行調(diào)節(jié)其擴(kuò)增和持續(xù)存在,在需要較高藥效的適應(yīng)癥中可能具有優(yōu)勢(shì)。
☆ 攜帶瞬時(shí)表達(dá)RNA的脂質(zhì)納米顆粒(LNP),主要通過抗體功能化實(shí)現(xiàn)T細(xì)胞工程化和細(xì)胞靶向,高生物降解性和低反應(yīng)原型的可電離脂質(zhì)則適合于重復(fù)給藥。這類平臺(tái)可以通過調(diào)整給藥方案,相對(duì)獨(dú)立于抗原負(fù)荷來控制暴露,在安全性要求更高的適應(yīng)癥中可能具有優(yōu)勢(shì)。
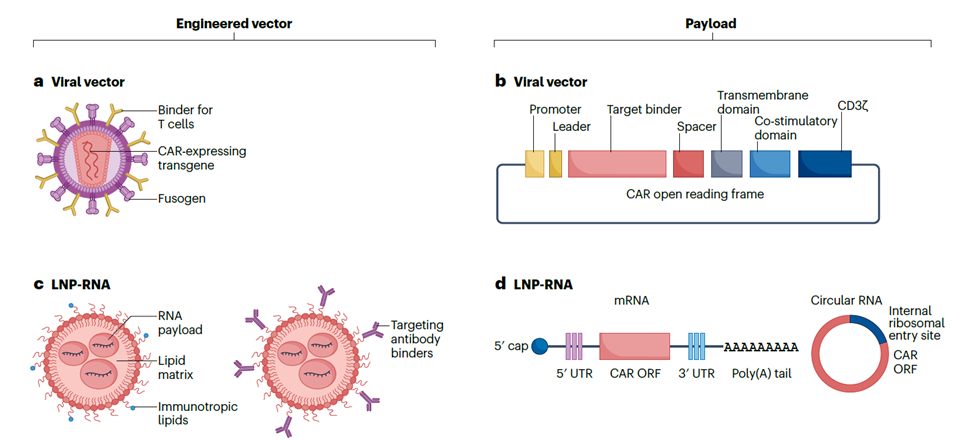
主流體內(nèi)CAR-T平臺(tái)的工程化載體與載荷
簡(jiǎn)言之,在LNP表面連上與T細(xì)胞表面受體結(jié)合的抗體或抗體片段,就能“鉤住"T細(xì)胞,進(jìn)而被T細(xì)胞攝取。
在體內(nèi)遞送中,抗體的特異性、純度和功能性至關(guān)重要,任何微小的偏差都可能導(dǎo)致脫靶效應(yīng)或激活異常免疫反應(yīng),來自Bio X Cell的高品質(zhì)抗體已助力多項(xiàng)體內(nèi)CAR-T的LNP遞送研究。如需購(gòu)買美國(guó)Bio X Cell公司產(chǎn)品,請(qǐng)聯(lián)系Bio X Cell授權(quán)代理商兼中國(guó)現(xiàn)貨庫(kù)存中心——欣博盛生物。
Bio X Cell抗體LNP遞送研究案例
長(zhǎng)效體內(nèi)CAR-T結(jié)合IL-6有效沉默
2022年,華東師范大學(xué)化學(xué)與分子工程學(xué)院俞磊與閆志強(qiáng)聯(lián)合團(tuán)隊(duì)發(fā)表研究,構(gòu)建同時(shí)包含CD19-CAR與IL-6 shRNA編碼基因的質(zhì)粒,并將其封裝入LNP,并修飾以Bio X Cell的人CD3抗體(#BE0001-1)作為靶向配體,形成AntiCD3-LNP/CAR19+shIL6。
在注射白血病小鼠后,AntiCD3-LNP顯著富集于淋巴結(jié)/脾臟等淋巴組織,且能穩(wěn)定轉(zhuǎn)染體內(nèi)的T細(xì)胞,將其轉(zhuǎn)化為IL-6低分泌型的CAR-T細(xì)胞。質(zhì)粒DNA載荷實(shí)現(xiàn)了長(zhǎng)達(dá)90天的穩(wěn)定CAR表達(dá),顯著延長(zhǎng)白血病小鼠的生存,表現(xiàn)出與傳統(tǒng)CAR-T相當(dāng)?shù)目鼓[瘤效果,同時(shí)有效沉默IL-6減少CRS發(fā)生。

LNP在小鼠體內(nèi)的生物分布,以及在體內(nèi)產(chǎn)生的CAR-T細(xì)胞量

體內(nèi)產(chǎn)生的CAR-T細(xì)胞顯著延長(zhǎng)了白血病小鼠生存期,且降低了體內(nèi)IL-6濃度
肝外靶向Ab-LNP工程化開發(fā)
2023年底,賓夕法尼亞大學(xué)Michael J. Mitchell教授團(tuán)隊(duì)發(fā)表研究,成功開發(fā)了一種靶向T細(xì)胞的工程化抗體-LNP(Ab-LNP),將針對(duì)不同泛T細(xì)胞標(biāo)志物(CD3、CD5、CD7)的抗體片段連接到 LNP 表面,比較了不同抗體片段的遞送效率、生物分布與功能學(xué)結(jié)果。裝載 CD19 CAR mRNA后,治療組出現(xiàn)了劑量依賴的 CAR 表達(dá)、短期的細(xì)胞因子升高以及對(duì) B 細(xì)胞高達(dá) ~90% 的清除,CD3-LNP 在不同劑量下表現(xiàn)出最-強(qiáng)的遞送。
其中 Bio X Cell 提供的小鼠 CD3?抗體為F(ab)? 形式,省去了酶解切割步驟,直接進(jìn)行還原處理即可獲取與LNP 結(jié)合的片段,為研究提供了極大的便利。

Ab-LNP在體內(nèi)成功生成CAR-T細(xì)胞并清除B細(xì)胞
Bio X Cell:助您領(lǐng)-跑體內(nèi)研究
正如我們?cè)谶@兩項(xiàng)研究中看到的,無論是開發(fā)LNP靶向遞送系統(tǒng),還是進(jìn)行CAR-T、免疫學(xué)或腫瘤學(xué)的體內(nèi)研究,一個(gè)高品質(zhì)、高純度、低內(nèi)毒素的抗體都是不-可或-缺的。
為什么選擇Bio X Cell?
高品質(zhì):采用經(jīng)典抗體克隆,所有抗體經(jīng)嚴(yán)格質(zhì)控,低內(nèi)毒素、無載體蛋白,適合體內(nèi)功能學(xué)實(shí)驗(yàn)。
應(yīng)用廣泛:不止CAR-T,在免疫檢查點(diǎn)抑制、腫瘤模型構(gòu)建等領(lǐng)域都大顯身手,已有超過25000篇論文引用。
高性價(jià)比:提供大包裝選項(xiàng),適合實(shí)驗(yàn)室批量使用。
參考文獻(xiàn)
Bot, A, et al (2025) In vivo chimeric antigen receptor (CAR)-T cell therapy. Nature Review Drug Discovery. Online ahead of print.
Li, Y, et al (2025) In vivo CAR engineering for immunotherapy. Nature Review Immunology. 25(10):725-744.
Zhou, J, et al (2022) Lipid nanoparticles produce chimeric antigen receptor T cells with interleukin-6 knockdown in vivo. Journal of Controlled Release. 350:298-307.
Billingsley, MM, et al (2024) In vivo mRNA CAR T cell engineering via targeted ionizable lipid naoparticles with extrahepatic tropism. Small. 20(11):e2304378.
如需了解更多詳情,請(qǐng)聯(lián)系Bio X Cell授權(quán)一級(jí)代理商欣博盛生物