諾獎啟示:Treg——腫瘤免疫的“剎車器"
2025年的諾貝爾生理學或醫學獎,將金光閃閃的獎章授予了調節性T細胞(Treg)的發現。Treg本是維持機體免疫平衡、防止自身免疫疾病的“守護神"。然而,在腫瘤微環境(TME)中,它們卻“叛變"為腫瘤細胞的幫兇,浸潤在腫瘤組織中,抑制效應T細胞的活化和功能,給免疫系統踩下“剎車",形成所謂的“冷腫瘤",導致免疫治療無效。
諾獎不僅是對Treg作用重要性的肯定,更將一個亟待回答的問題擺在了全-球科學家的面前:在腫瘤內部,如何精準調控Treg,將“冷腫瘤"轉化為“熱腫瘤",釋放被抑制的抗腫瘤免疫力?
就在今年早些時候,一篇來自斯坦福大學的Science論文,揭示了腫瘤抵抗免疫攻擊的全新機制,并指出超越現有Treg調節策略的潛在靶點。
意料之外的“幕后黑手":腫瘤源性EPO
在比較非炎癥型(T細胞稀少,“冷")和炎癥型(T細胞豐富,“熱")肝癌小鼠模型時,一個現象引起了科學家們的注意:那些對免疫治療無效的“冷腫瘤"小鼠體內,促紅細胞生成素(EPO)的水平異常之高。
EPO?那不是促進紅細胞生成、治療貧血的激素嗎?它怎么會出現在腫瘤免疫的故事里?
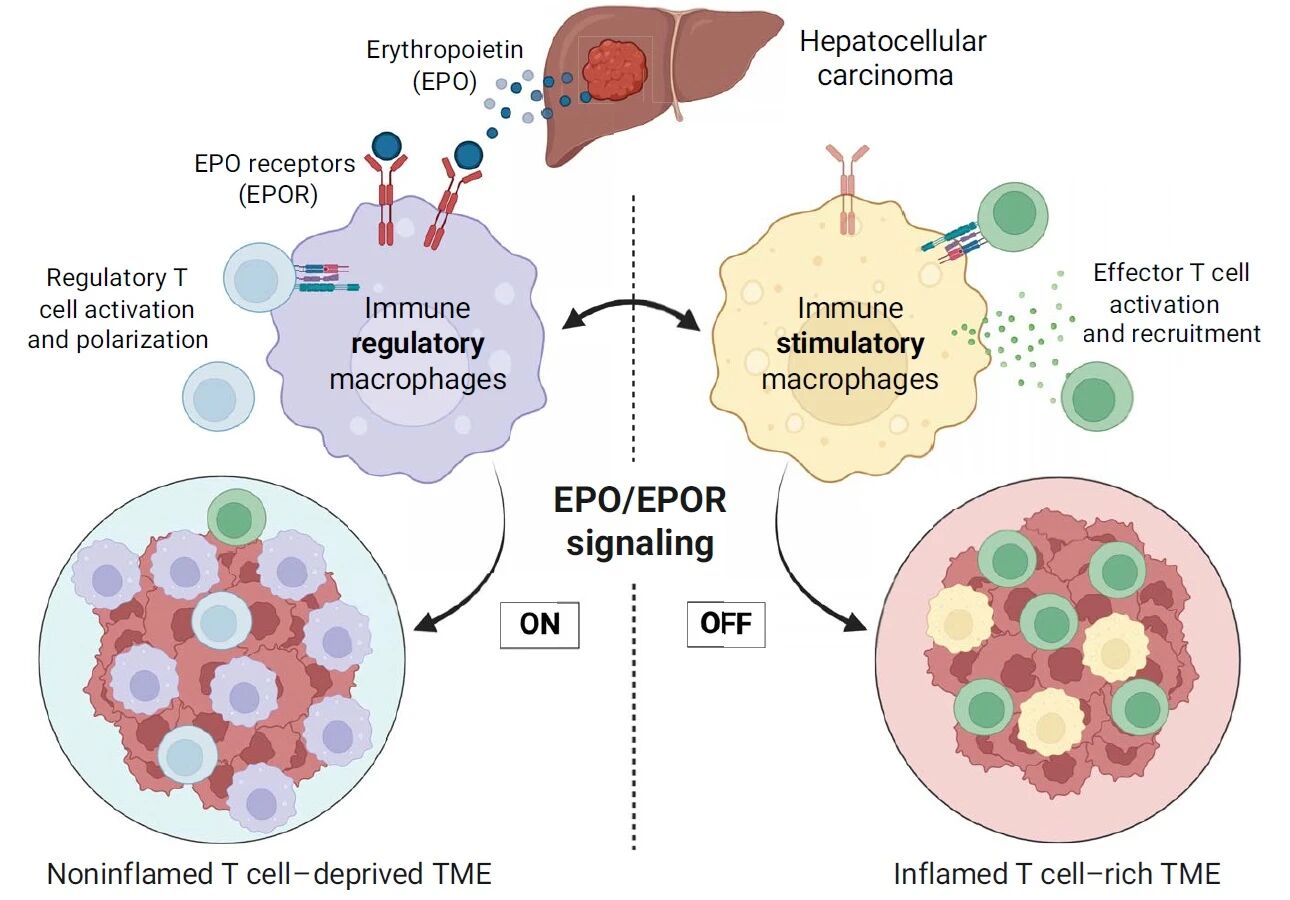
隨著探究的深入,一個驚人的真相浮出水面:原來,某些腫瘤細胞非常“狡猾",它們大量分泌EPO,但目的并非制造紅細胞,而是進行一場精密的 “免疫政-變"。
“策反"巨噬細胞:EPO的免疫壓制術
腫瘤分泌的EPO,精準地找到了它們在TME中的“幫兇"——高表達EPO受體(EPOR)的巨噬細胞。
在EPO的持續“蠱-惑"下,巨噬細胞被“洗-腦"成免疫抑制性的Kupffer細胞樣表型。它們不再履行抗原提呈、激活T細胞的職責,轉而開始促進Treg細胞的活化與極化,并抑制CD8+效應T細胞的浸潤與活化。
簡言之,來自腫瘤細胞的EPO,就像一個“總開關",通過重編程巨噬細胞,開啟了一個利于Treg生存、抑制效應T細胞功能的“免疫荒漠"。
關鍵驗證:Bio X Cell抗體助力鎖定真兇
在這項前沿探索中,Bio X Cell的體內功能級抗體,作為關鍵研究工具,幫助科學家們撥開迷霧,確鑿地驗證了多個關鍵環節。
01 證實Treg是免疫抑制的執行者
為了證明Treg是EPO下游的關鍵效應細胞,研究團隊使用了αCD25和αCTLA-4等抗體,在小鼠體內清除Treg細胞。
方法:將3×10?過表達Epo的Hepa1-6細胞移植至C57BL/6小鼠肝臟,移植后第14、17及20天,分別腹腔注射2mg/kg Bio X Cell的αCD25(PC-61.5.3)和αCTLA-4(9H10)等抗體以清除Treg細胞,對照組注射IgG同型對照(Bio X Cell, hamster polyclonal),在第21天收集腫瘤及脾臟進行分析。
結果:在Epo過表達的頑固腫瘤中,清除Treg后,腫瘤發生了顯著消退。這直接證明,EPO介導的免疫逃逸,高度依賴于Treg的免疫抑制功能。
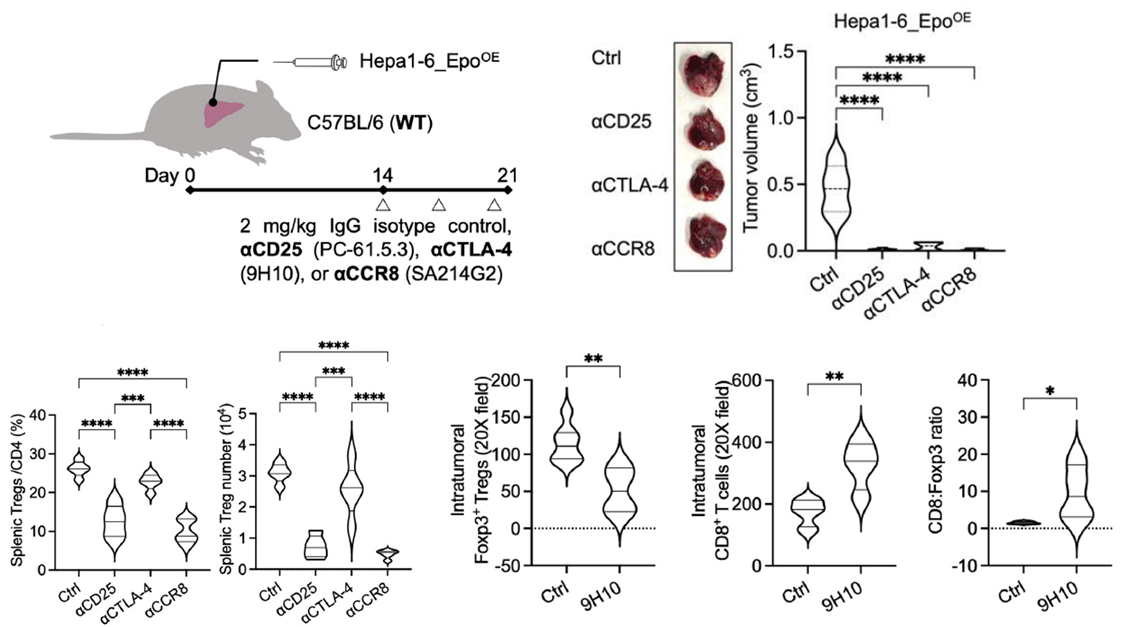
體內清除實驗分析Treg在EPO誘導的肝癌免疫抑制中的作用
02 確認CD8+ T細胞是最終的腫瘤“殺手"
當研究者敲除巨噬細胞上的EPOR后,腫瘤生長被有效抑制。但他們需要確認,這是否真的由T細胞介導,于是使用抗體在體內分別清除CD8+和CD4+ T細胞。
方法:首先構建LysM驅動的成熟髓系細胞(主要是肝臟和肝癌中的巨噬細胞)EPOR敲除,隨后利用流體動力學尾靜脈注射(hydrodynamic tail vein injection,HDTV)構建“冷腫瘤"肝癌模型。兩周后,小鼠腹腔注射4mg/kg αCD8(Bio X Cell,YTS169.4)、αCD4(Bio X Cell,GK1.5)或IgG同型對照(Bio X Cell,LTF-2),第-一周兩次,隨后每周一次(總共6劑),測定總生存期。
結果:清除CD8+ T細胞后EPOR缺失帶來的抗腫瘤效果消失,證明打破EPO/EPOR軸所釋放的正是CD8+ T細胞介導的抗腫瘤免疫力。
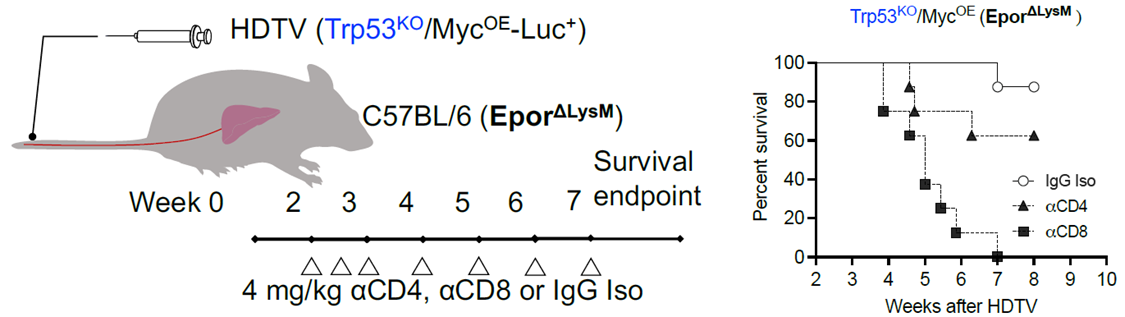
CD8+或CD4+ T細胞清除對EPO/EPOR誘導的免疫抑制的影響
03 EPO信號阻斷與免疫檢查點阻斷完-美協同
研究人員進一步探索了EPOR靶向敲除與免疫檢查點阻斷免疫治療的聯合效應,使用αPD-1抗體治療巨噬細胞EPOR敲除小鼠。
方法:通過HDTV給藥質粒混合物后,小鼠每3天腹腔注射10mg/kg的αPD-1(Bio X Cell,RMP1-14)或IgG同型對照(Bio X Cell,2A3),總共5劑,生物發光成像評估腫瘤生長動力學,并測定總生存期。
結果:在PD-1抗體單藥無效的“冷腫瘤"中,“靶向EPO/EPOR信號+αPD-1抗體"組合實現了驚人的協同效應,所有小鼠的完-全腫瘤消退!
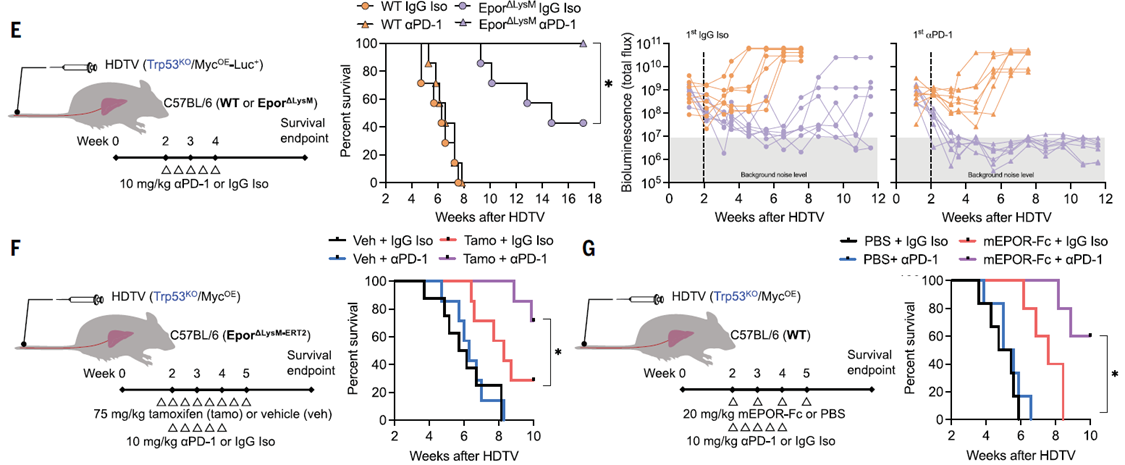
巨噬細胞中EPOR的缺失增強對PD-1抗體免疫治療的應答
04 排除EPO通過EDMC實現免疫抑制
由于EPO能夠刺激紅系祖細胞誘導其分化為促腫瘤的紅系分化髓系細胞(EDMC),研究人員使用抗體在體內清除EDMC/紅系祖細胞以區分免疫抑制作用來自于EDMC還是巨噬細胞。
方法:HDTV后2周,小鼠每3天腹腔注射2mg/kg αTer-119(Bio X Cell,TER-119)或IgG同型對照(共9劑),測定總生存期,并觀察αPD-1抗體治療的聯合效應。
結果:EDMC/紅系祖細胞清除不能改善非炎癥型HCC小鼠的生存,也不能增強其對PD-1阻斷的響應,表明EPO對TME的免疫調節作用并非通過EDMC介導。
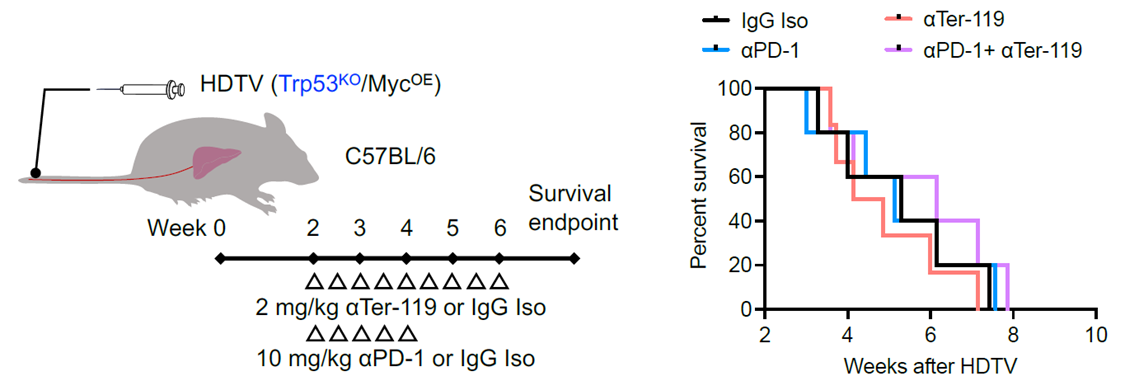
在“冷腫瘤"模型中分析EDMC對免疫耐藥的影響
展望未來:從基礎研究到臨床轉化
這項研究不僅發現了一個全新的免疫抑制軸心EPO/EPOR,將Treg、巨噬細胞和效應T細胞的調控聯系起來,更提示針對EPO/EPOR的干預可能成為下一代腫瘤免疫聯合治療。
從諾獎對Treg免疫學功能的肯定,到前沿研究對Treg在TME中調控機制的深入挖掘,Bio X Cell始終致力于為全-球科學家提供高品質的功能級抗體,助力科學家探索未知機制,架起科學假說通向臨床轉化的橋梁。
Treg研究產品推薦
Bio X Cell提供兩個系列的小鼠CD25抗體(PC-61.5.3)常用于體內清除CD4+FoxP3+ Treg
InVivoMAb anti-mouse CD25 (IL-2Rα)
InVivoPlus anti-mouse CD25 (IL-2Rα)
參考文獻
1. Press release. The Nobel Prize in Physiology or Medicine 2025.
2. Chiu, DK, et al (2025) Tumor-derived erythropoietin acts as immunosuppresive switch in cancer immunity. Science. 388(6745):eadr3026. doi: 10.1126/ science.adr3026.
如需了解更多詳情,請聯系Bio X Cell授權一級代理商欣博盛生物